产品分类
PRODUCTS CATEGORY
推荐产品
RECOMMENDED PRODUCTS
联系我们
CONTACT US
Q Q: 43834183
邮箱:43834183@qq.com
地址:北京市大兴区黄村安顺南路
液氮罐中细胞的安全取出与复苏操作指南
从液氮罐中取出冷冻的细胞,是细胞培养和生物样本库管理中的一项关键操作。这个过程看似简单,但其中蕴含着巨大的风险:既关乎操作者的人身安全(冻伤、窒息),也关系到珍贵细胞样本的存亡(交叉污染、活性降低)。遵循标准流程是确保人与样本安全的前提。
一、操作前的核心准备
1. 个人安全防护:
这是不可妥协的第一步。液氮的温度低至-196℃,接触皮肤会造成严重冻伤。
防冻手套:必须佩戴宽松、保暖的专用低温手套,切勿使用湿手套。
护目镜:全程佩戴,防止液氮飞溅入眼。
实验服:穿好长袖实验服和封闭的鞋子,避免皮肤暴露。
长裤:确保穿着长裤,保护腿部。
2. 环境与设备准备:
通风良好:确保操作区域空气流通,避免液氮挥发导致局部空间氧气含量过低,引起窒息风险。
检查装备:
长柄镊子:用于夹取细小的冻存管。
提篮手柄:确保与罐内提篮的连接处完好。
专用转移容器:准备好一个足够深的杜瓦罐或小型液氮罐,用于临时放置取出的提篮和样本,防止样本在空气中升温。
规划与识别:提前确认好目标细胞样本在液氮罐中的具体位置(例如,第X号提篮,第Y行第Z列),做到“快、准、稳”,尽量减少罐口的开启时间。
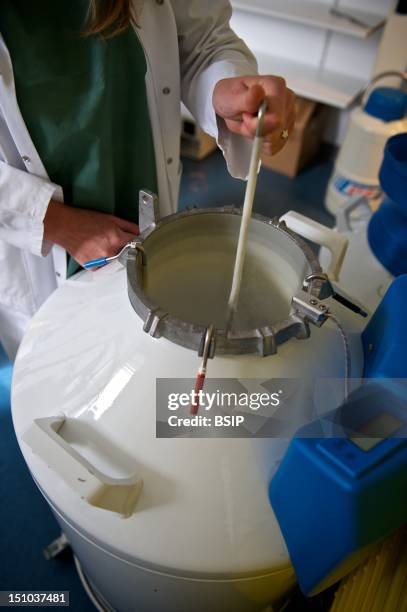
二、取出流程:规范操作是关键
1. 开启罐盖:
平稳地移除液氮罐的颈塞和盖盖。动作轻柔,避免大幅度搅动。
2. 提取提篮:
将提篮手柄牢固地连接到目标提篮的挂钩上。
平稳而迅速地将提篮从液氮中提升至罐口附近。此时,整个提篮和样本都处于超低温状态,会剧烈地沸腾和喷溅液氮,属正常现象,保持冷静。
切勿将提篮完全提出罐口,应使其大部分体积仍处于罐颈的冷气区中。
3. 定位并夹取目标冻存管:
在罐口冷气区内,快速用长柄镊子在提篮中寻找目标冻存管。
夹取时,最好夹住冻存管的盖子上部,避免夹管身,以防损坏或导致管盖意外开启。
夹取动作要稳,防止碰到其他样本,造成交叉污染或标识脱落。
4. 快速转移与复查:
一旦夹住目标冻存管,立即将其转移至准备好的、预冷过的专用转移容器(杜瓦罐) 中。这个过程在空气中的暴露时间应控制在几秒钟之内。
如果需要取出多个样本,建议分批操作,每次只取一个,并立即放回转移容器,不要将所有样本都长时间暴露在空气中。
取出所有目标样本后,迅速、平稳地将提篮放回液氮罐中原有的位置。
立即盖好罐盖和颈塞,恢复液氮罐的密封保温状态。
三、核心安全原则与常见误区
1. 安全原则:
“三防”原则:
防冻伤:任何时候身体都不要接触液氮、冻存管金属部分或提篮。
防爆炸:这是最重要的一点!如果冻存管在液氮中浸泡时密封不严,液氮可能渗入管内。取出后,管内液氮受热急剧气化,体积膨胀约680倍,会产生巨大压力,可能导致冻存管爆炸(喷出管盖或管体破裂)。因此,操作时务必佩戴好护目镜和面罩,并将冻存管始终置于防护盖后面。
防窒息:保证通风。
速度原则:整个操作过程要“稳中求快”,最大限度地减少样本在室温下的暴露时间。温度的剧烈波动会严重损害细胞活性。
2. 常见误区与禁忌:
禁忌:直接用手取管。皮肤会瞬间粘在超低温的金属或塑料上,造成撕裂性冻伤。
禁忌:将取出的样本长时间放在桌面上。细胞冻存液中的DMSO在较高温度下对细胞有毒性,缓慢升温会显著降低细胞复苏的存活率。
禁忌:在液氮罐正上方操作。防止液氮滴落或冻存管爆炸时伤及面部。
禁忌:让提篮完全离开罐口长时间寻找样本。这会导致提篮内所有样本升温,影响其他细胞的保存质量。
四、取出的后续步骤:细胞复苏
取出冻存管仅仅是第一步,接下来需要进行规范的细胞复苏:
从转移容器中取出目标冻存管,立即放入37℃的恒温水浴锅中,并不断摇晃,使其在1-2分钟内完全解冻。
解冻后,用酒精彻底消毒冻存管外壁。
将细胞悬液转移至含有预温培养基的培养器皿中,进行后续培养。
总结
从液氮罐中取出细胞是一项严谨的技术工作。成功的标准不仅是拿到了样本,更是确保了操作者的绝对安全,并最大限度地保持了细胞的高活性和无污染状态。牢记防护、迅速、规范三大要点,是顺利完成这项工作的根本保障。









